I poteri delle Agenzie del farmaco: perché Ema arriva 20 giorni dopo
La campagna di vaccinazione europea, ormai l’abbiamo capito, è iniziata in ritardo rispetto agli Usa e al Regno Unito perché l’autorizzazione delle agenzie regolatorie, ossia il via libera all’uso dei vaccini, è arrivata venti giorni dopo. Pfizer/BioNTech ottiene l’autorizzazione il 2 dicembre dall’Mhra inglese, l’11 dicembre dall’Fda americana, mentre solo il 21 dicembre dall’Ema europea. Lo stesso per Moderna: Fda 18 dicembre, Ema 6 gennaio, Mhra 8 gennaio. AstraZeneca: Mhra 30 dicembre, Ema 29 gennaio, Fda non ha ancora sciolto le riserve.
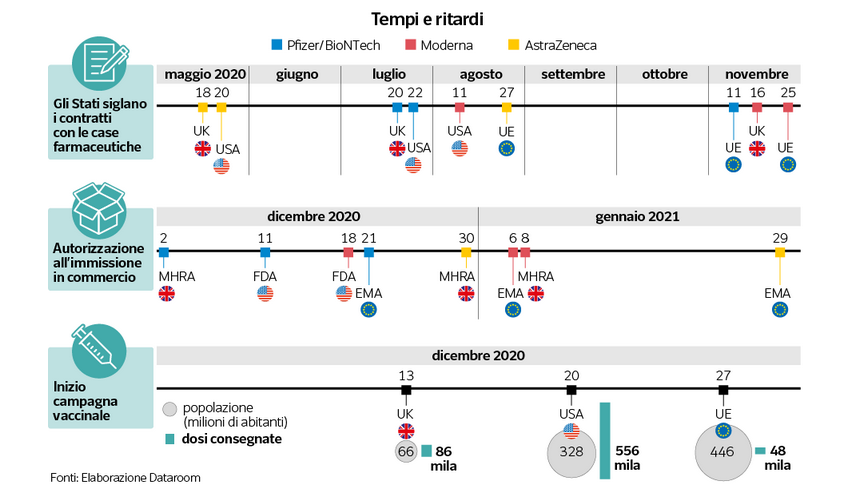
Ma cosa sta davvero dietro a quello che viene liquidato come un semplice ritardo di Ema? La mancanza di uno strumento che consente, in contesti di emergenza, e mancanza di alternative, di approvare con una procedura più veloce l’uso di medicinali. L’Fda invece questo potere lo possiede e lo ha esercitato, come pure la Gran Bretagna. In Europa l’emergency use authorisation è delle agenzie del farmaco dei singoli Stati, ma non è mai stata contemplata nella legislazione europea per volontà dei Paesi membri di limitare il ruolo di Ema, che ha così dovuto seguire un iter più lungo. Dopo l’epidemia di Ebola 2014-2016, si è discusso della necessità del valore di tale strumento a livello europeo, ma senza successo. Ora che abbiamo toccato con mano, la questione è tornata sul tavolo.
I retroscena delle trattative: chi c’era al tavolo a negoziare
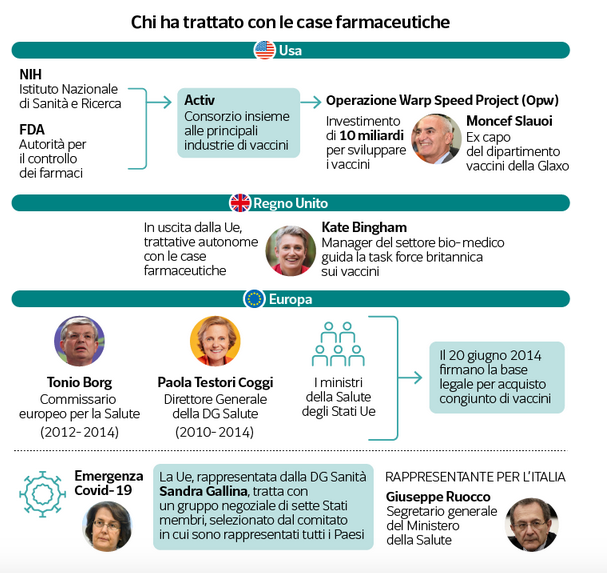
La mancanza di un mandato forte la scontiamo anche nelle trattative con le case farmaceutiche. Stati Uniti e Gran Bretagna siglano gli accordi per l’acquisto delle dosi con Pfizer e AstraZeneca fra maggio e luglio, l’Europa arriva dai tre ai quattro mesi dopo. Con Moderna gli Usa chiudono l’11 agosto, la Ue il 25 novembre. Gli americani, dopo l’epidemia suina H1N1 hanno cominciato a investire nella ricerca sui vaccini e creato una apposita autorità, il Barda. A finanziare e coordinare le ricerche l’Istituto Nazionale di Sanità (Nih); mentre ad accompagnare lo sviluppo degli studi clinici, imponendo anche i protocolli da seguire, c’è l’Fda. Queste agenzie pubbliche creano, il 17 aprile 2020, il consorzio Activ, una partnership pubblico-privato dove siedono le principali industrie farmaceutiche, finanziate inizialmente con 10 miliardi di dollari, con lo scopo di coordinare le ricerche e sviluppare velocemente un vaccino. La Gran Bretagna, in uscita dalla Ue, e con un produttore in casa (AstraZeneca) di fatto tratta per sé stessa. In Europa invece non solo sono stati fatti pochi investimenti mirati nella ricerca sullo sviluppo di vaccini, ma su pressione di una parte dell’opinione pubblica diffidente, è stato smantellato quel che già c’era. Pertanto la capacità produttiva, oggi tanto invocata in nome dell’autonomia dagli altri Paesi, si è ridotta: Baxter e Novartis hanno chiuso con i vaccini, GSK ha trovato più conveniente espandersi in America. Realtà importanti, ma piccole, come BioNTech, Oxford e CureVac non bastano all’Europa per affrontare l’immensa sfida. Così dopo aver capito che pochi Paesi hanno la forza di trattare da soli, si delega la Commissione europea a negoziare per tutti. Ma non ha un apparato esperto e nemmeno un’autorità specifica: un potere che gli Stati membri non hanno mai voluto concedere.L’unico strumento che possiede dal 2014 è la base legale per l’acquisto congiunto di vaccini pandemici costruita dall’allora direttore generale Salute, Paola Testori Coggi, dopo la febbre suina del 2009, quando ogni Paese, andando per conto proprio, aveva speso miliardi.
Le condizioni a cui acquista l’Europa: le clausole secretate dei contratti
Negoziare un prodotto farmaceutico è un’attività molto complessa e richiede competenze specifiche, ma all’interno della Commissione non ci sono. Ursula von der Leyen opera la migliore delle scelte possibili: sposta in corsa da Dg Commercio a Dg Salute Sandra Gallina, abile nel suo settore, ma senza l’esperienza che serve in questo caso. La direttrice generale avvia i lavori con un gruppo negoziale di sette Stati membri, selezionato dal comitato direttivo in cui sono rappresentati tutti i Paesi. Per l’Italia la scelta migliore sarebbe stata quella di delegare il direttore dell’ufficio che prepara i dossier negoziali dell’Agenzia Italiana del Farmaco, che conosce tutti i trucchi del mestiere, ma si è preferito mandare Giuseppe Ruocco, segretario generale del Ministero della Salute.
Alla fine dettano le condizioni: la Ue partecipa al rischio d’impresa nell’ampliamento della catena di produzione con un contributo di 2,8 miliardi di euro, da scalare dal prezzo di ogni fiala sulla prima fornitura.
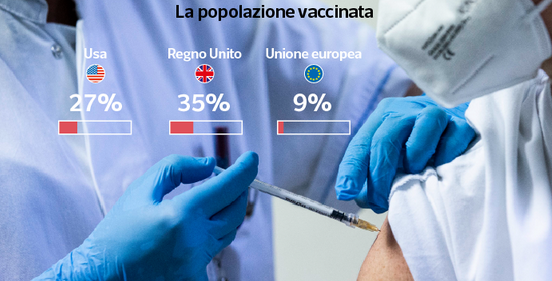
Fortunatamente il vaccino si trova e funziona. L’accordo prevede che gli eventuali effetti collaterali siano totalmente a carico dei singoli Stati (qui il documento). I vincoli di consegna: la dicitura utilizzata è che la casa farmaceutica «farà tutto il possibile», ma non viene stabilita nessuna penale in caso contrario (qui il documento). C’è l’ok di tutti i Paesi membri. Concordato il prezzo, vengono opzionate 2,6 miliardi di dosi, da distribuire ad ogni Paese in proporzione alla popolazione. A dicembre parte la campagna vaccinale e il risultato è questo: la Ue parte con 48 mila dosi, la Gran Bretagna con 86 mila, gli Usa con 556 mila. Nonostante il corposo contributo, siamo gli ultimi della fila.
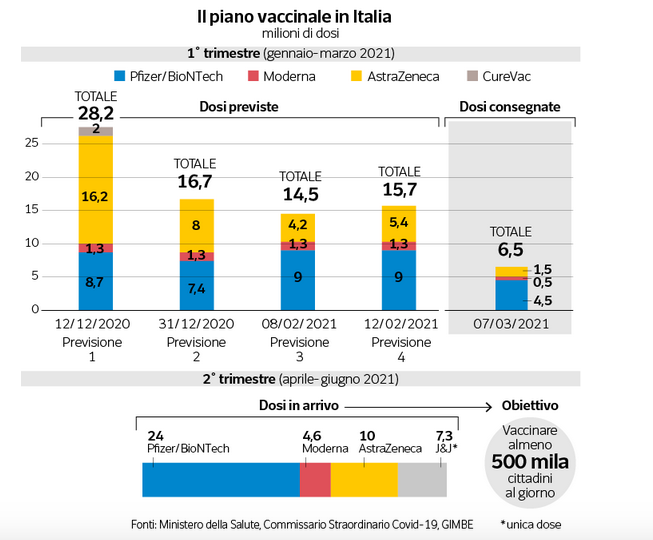
La situazione italiana: i vaccini consegnati e quelli in arrivo
Il nostro piano vaccinale del 12 dicembre prevedeva la consegna, fra gennaio e marzo e da più fornitori, 28,2 milioni di dosi (qui il documento). L’unica pronta a consegnare era Pfizer-BioNTech, e tutti hanno chiesto a Pfizer, che ha dovuto spartire le dosi, con un occhio di riguardo alla Germania, che aveva finanziato con la loro ricerca con 325 milioni. Sta di fatto che nei documenti del 12 febbraio le forniture vengono ridotte a 15,7 milioni (qui il documento). I tagli più pesanti sono operati da AstraZeneca. Le ragioni «sospette» è che in parte abbiano preso altre destinazioni, ma ci sono anche quelle tecniche (non ci sono scorte, e basta un malfunzionamento per ritardare la produzione). Pertanto le consegne, per settimane avvengono a singhiozzo. A ieri Pfizer/BioNTech ha consegnato 4,5 milioni di dosi su 9 (50%), Moderna 493 mila su 1,3 milioni (38%) e AstraZeneca 1,5 milioni su 5,4 (28%). Tra gennaio e febbraio complessivamente abbiamo ricevuto 6,3 milioni di vaccini, ciò vuol dire che nel mese di marzo complessivamente ne avremo 9,4 milioni (9,1 milioni ancora da consegnare). E da aprile sono in programma consegne per altri 24 milioni da Pfizer/BioNTech, 4,6 da Moderna, 10 da AstraZeneca e 7,3 del nuovo vaccino monodose Johnson & Johnson (qui il documento). Significa che occorre essere pronti con la macchina organizzativa, e che tagli e ritardi non potranno più essere un alibi per giustificare le inefficienze del sistema che ci sono state finora. Vediamo quali.
Cosa funziona e cosa no: più dosi che capacità di farle
Per velocizzare le somministrazioni serve personale: in Finanziaria vengono stanziati 508 milioni di euro, messi nelle mani del commissario all’emergenza (fino alla scorsa settimana Domenico Arcuri) per assumere 3 mila medici e 12 mila infermieri. Il compito di trovarli è affidato alle agenzie interinali. Finora non è arrivata neppure la metà del personale previsto. Nel piano vaccinale del 2 gennaio, che per decreto deve essere attuato dal commissario, ci sono indicazioni generiche sulle categorie che hanno la priorità (personale sociosanitario, ospiti delle case di riposo, over 80, malati cronici, poi per età). I vaccini sono distribuiti dal Commissario con un doppio binario: per Pfizer e Moderna su numeri indicati dalle Regioni (che hanno calcolato ognuna con criteri diversi), mentre per AstraZeneca si va in percentuale rispetto alla popolazione Istat. Da lì in avanti la responsabilità e le scelte sono delle Regioni. In base alla circolare del commissario Arcuri del 12 gennaio su 100 vaccini che arrivano, 30 vanno messi da parte come scorta per il richiamo (qui il documento). Se guardiamo i dati generali, la differenza tra vaccini consegnati e somministrati, pur con variazioni regionali, è in linea con le scorte da tenere (dal 3 marzo il Ministero formalizza che per AstraZeneca basta un’unica dose per chi ha già avuto il Covid). Ma è sufficiente scomporre i dati per capire che le cose non vanno così bene. Finché gli ospedali devono vaccinare medici, personale sociosanitario e gli ospiti delle case di riposo, l’organizzazione funziona: da fine dicembre al 7 febbraio, su dieci dosi arrivate ne vengono somministrate circa nove.
La velocità della campagna di vaccinazione comincia a rallentare proprio nella settimana 8-14 febbraio: su 100 dosi consegnate ne sono state somministrate solo 36, quella dopo 46, la successiva 67. A ieri il Lazio ha vaccinato 146.861 (37%) over 80, l’Emilia-Romagna 110.682 (30%), la Lombardia il 115.480 (16%), la Sicilia 57.983 (18%). Con AstraZeneca (richiamo dopo 12 settimane) si parte da insegnanti e forze dell’ordine. Docenti e personale scolastico in genere vaccinati in Toscana intorno ai 43 mila, in Campania 64 mila, in Lombardia 2.651. Al 5 marzo (rilevazione Gimbe per Dataroom) su 1,5 milioni di dosi AstraZeneca consegnate ne sono state utilizzate solo 516.489. Le altre sono tutte nei frigoriferi.
La campagna di massa: basta con le Regioni in ordine sparso
Da aprile inizierà la campagna di massa, che vuol dire almeno 500 mila persone al giorno. Sarà possibile? Forse si, ma deve essere velocemente attuato un piano operativo strategico nazionale che finora non è mai stato fatto. In sintesi: nessuno ha ancora detto «tu Regione devi rispettare questo obiettivo, dimmi che personale utilizzi, qual è il tuo modello organizzativo, e io commissario ti monitoro». Oltre a indicare il sistema di appuntamenti. Il modello della Gran Bretagna porta a considerare migliore la modalità a chiamata piuttosto che su prenotazione. Da una settimana abbiamo un nuovo commissario, Francesco Paolo Figliuolo, esperto in logistica. È stato anche potenziato il ruolo della Protezione Civile. Speriamo bene.
di Milena Gabanelli e Simona Ravizza
Fonte: Corriere della Sera, 8 marzo 2021

